現在使われているすべての放射線リスク評価や放射線防護基準とその遂行は、いわゆる「直線しきい値なし仮説」に基づいている。この仮説によるとリスクにはしきい値がなく、線量に直線的に比例するとされる。つまり、
-
放射線はどんなに少量であろうとリスクは必ず伴う
-
単位線量当たりのリスクは一定
-
生物学的な作用因子は取るに足りない
ということになる。
ここでは低LET放射線を用いた低線量/低線量率放射線の発がんにおける作用を検討し、果たしてLNT仮説が正しいかどうかを考察する。
がんは一つの細胞から発生するので「低線量」という概念の最小限界を決めることが出来る。発がんリスクを考えるときに考慮しなければならない最小の生体容積は一個の細胞の容積である。したがって最小線量とは一個の細胞に蓄積される線量のことだ。
また以下のことも認識すべきだ。
-
細胞を通過することによって放射線はエネルギーと傷害を細胞に蓄積する
-
細胞が受け取ることのできる最小線量は一つの放射線の通過によって与えられる
-
放射線の数が細胞数より少ない場合でも、放射線が通過する細胞ではひとつの放射線の通過 によるエネルギーと傷害の蓄積がある
また細胞がうける実際の線量は線種による。例えば、α線は通過細胞に何10cGyものエネルギーを与え、コバルト-60のγ線では平均1mGyだ。
DNA傷害の結果は、①エラーのない修復により正常に修復される②アポトーシスにより死ぬ③エラーをしがちな修復で変異が残る、の3通りある。LNT仮説ではこれらの比率は線量に依存せず一定であるはずだ。
このことを実験的に確かめた。急性高線量照射による染色体の傷害は低線量/低線量率の事前照射によって低減された。事前照射は細胞の修復能力を刺激し向上させた。事前照射が500mGyでも1mGyでも同様な結果が得られた(図1)。

図1 低線量照射により適応応答した細胞のDNA修復能力
このような適応応答はアポトーシスにおいても見られた。事前照射はアポトーシスの頻度を上昇させた。つまり、傷害の残る細胞の死ぬ確立を増大させることによって発がんの可能性を低減させると考えられる。
これらの作用の総合的な影響として、培養細胞のがん化に対する影響を測定した。低線量率の前照射(1mGy)はその後の急性高線量の照射によるがん化のリスクを増大はせず、むしろがん化の確率を1/2から1/3に低減した(表1)。
|
照射の種類
|
発生頻度(・10-4)
|
|
コントロール
|
3.7
|
|
4Gy(高線量率)
|
41
|
|
100mGy(低線量率)+
4Gy(高線量率)
|
16
|
表1 放射線照射による細胞の悪性変異に対する事前照射の抑制効果
この低線量率の照射のみでも自然におこるがん化(自然発がん)確率を低減する作用があった。低線量率での100mGyまでの照射は自然発がんを同様に1/2から1/3に低減した(表2)。
|
照射の種類
|
発生頻度(・10-3)
|
|
コントロール
|
1.8
|
|
1.0mGy
|
0.62
|
|
10mGy
|
0.39
|
|
100mGy
|
0.49
|
表2 自然発がんに対する低線量率での低線量照射(2.4mGy/min)の作用
1mGyではすべての細胞が照射を受ける訳ではないことから、照射を受けない細胞からのシグナルによって守られる細胞もあることがうかがえる。
これらの結果は低線量照射によってエラーのないDNA修復機能が向上し、また傷害細胞のアポトーシスを促進することでがん化の確率を低減することを示している。このことから生物学的な因子が重要であること、DNA傷害が一定でも相加的でもなく、常に線量と共に増加する訳でもないことが判る。低線量率での低線量照射はリスクを増大させるのではなく、低減する。そしてこのことはLNT仮説と相容れない。
マウスにおいても同様な結果を報告してきた。化学物質による皮膚がんの発生は24時間前にβ線を照射することによって1/5に低減した。また低線量率による低線量放射線照射は高線量照射による骨髄性白血病の発生の時期を遅らせた(表3)。
|
照射の種類
|
平均発症日数
|
短縮日数
|
|
コントロール
|
727
|
0
|
|
1.0Gy
|
486
|
241
|
|
100mGy, 24h, 1.0Gy
|
578
|
149
|
表3 急性骨髄性白血病発症までの時間の延長(潜伏期の延長)
このようなほ乳類細胞や動物における作用は、酵母のような下等真核細胞に見られるものと同じ応答だ。
ヒトの放射線防護の観点からはがん体質の個人と胎児への影響も考えなければならない。 Trp53遺伝子のヘテロ欠損マウスで実験を行った。10mGyの一回照射はこれらのマウスのがん発生確率を低下させ(図2)、また正常マウスの自然発がんに対しても防御的に作用した(表3)。
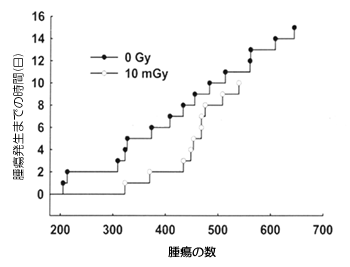
図2 Trp53欠損ヘテロマウスにおける脊髄骨肉腫の発生
また他に、放射線照射によって発生する胎児の奇形(尾の短縮)に対して低線量照射は防御的に作用した(図3)。

| 図3 |
高線量照射による尾の短縮に対する低線量事前照射の影響(懐胎11日目に30cGyを照射。24時間後4Gyを照射。懐胎18日目に尾の長さを測定) |
この作用は器官発生のある特定の時期でのみ有効で、Trp53遺伝子の欠損はこの防御作用に影響した。
結 論
低LET放射線の低線量/低線量率照射では発がんに関してLNT仮説を支持するデータはなく、多くのデータが反対のことを示している。したがってこの仮説は否定されるべきだ。放射線防護に用いられる考え方、例えば"可能な限り、被曝線量は低減するべき"とか、"予防的措置"という考え方は低線量放射線の生物学とは相容れない。現実の生体応答をもとにした、新しい放射線防護のリスク評価が必要な時期だ。
参考文献
| R.E.J. Mitchel and A. Trivedi: Radiation: What Determines the
Risk? In: Biological Effects and Physics of Solar and Galactic Cosmic
Radiation, C.E. Seenbergy et al. (eds.), Plenum Press, New York,
Part B, pp. 859-870 (1993). |
| R.E.J. Mitchel, E.I. Azzam and S.M. de Toledo: Adaption to Ionizing
Radiation in Mammalian Cells. In: Stress-Inducible Processes in
Higher Eukaryotes, T. Koval (editor), Plenum Press, New York, pp.
221-243 (1997). |
| E.J. Broome, D.L. Brown and R.E.J. Mitchel: Adaption of human
fibroblasts to radiation alters biases in DNA repair at the chromosome
level. Int. J. Radiat. Biol. 75, 681-690 (1990). |
| E.I. Azzam, G.P. Raaphorst and R.E.J. Mitchel: Radiation-Induced
Adaptive Response for Protection Against Micronucleus Formation
and Neoplastic Transformation in C3H 10t1/2 Mouse Embryo Cells,
Radiation Research. 138, S28-S31 (1994). |
| E.I. Azzam, S.M. de Toledo, G.P. Raaphorst and R.E.J.
Mitchel: Low-Dose Ionizing Radiation Decreases the Frequency of
Neoplastic Transformation to a Level Below the Spontaneous Rate
in C3H 10t1/2 Cells, Radiation Research. 146, 369-373 (1996). |
| S.P. Cregan, D.L. Brown, and R.E.J. Mitchel: Apoptosis and the
Adaptive Response in Human Lymphocytes. Int. J. Radiat. Biol. 75,
1087-1094 (1999). |
| S.P. Cregan, B.P. smith, D.L. Brown and R.E.J. Mitchel: Two
Pathways for the Induction of Apoptosis in Human Lymphocytes. Int.
J. Radiat. Biol. 75, 1069-1086 (1999). |
| R.E.J. Mitchel, N.J. Gragtmans and D.P. Morrison: Beta-Radiation-Induced
Resistance to MNNG Initiation of Papilloma but not Carcinoma Formation
in Mouse Skin. Radiat. Res. 121, 180-186 (1990). |
| R.E.J. Mitchel, J.S. Jackson, R.A. McCann and D.R. Boreham:
The Adaptive Response Modifies Latency For Radiation-Induced Myeloid
Leukemia In CBA/H Mice. Radiat. Res. 152, 273-279, (1999). |
| Y.Xu, C.L. Greenstock, A. Trivedi and R.E.J. Mitchel: Occupational
Levels of Radiation Exposure Induce Surface Expression of Inter-leukin-2
Receptor in Stimulated Human Peripheral Blood Lymphocytes. Radiation
and Environmental Biophysics. 35, 89-93 (1996). |
| D.R. Boreham, A. Trivedi and R.E.J. Mitchel: Radiation and Stress
Response in Saccharomyces Cerevisiae, In: Molecular Biology of Yeast
in Relation to Biotechnology, R. Prasad (editor). Omega Scientific,
pp. 295-314 (1991). |
| J. Graham,. D.J. Higson, J.-S. Jun, S. Kobayashi and R.E.J.
Mitchel: Low Doses Of Ionizing Radiation Incurred At Low Dose Rates.
Journal of the Australasian Radiation Protection Society, 16, 32-47
(1999). |
| R.E.J. Mitchel,and D.R. Boreham: Radiation Protection In The
World Of Modern Radiobiology: Time For A New Approach, Proceedings
of 10th International Congress of the International Radiation Protection
Association, Hiroshima, Japan, Plenary Session 1-2 p. 140, May 2000. |
![]()